|
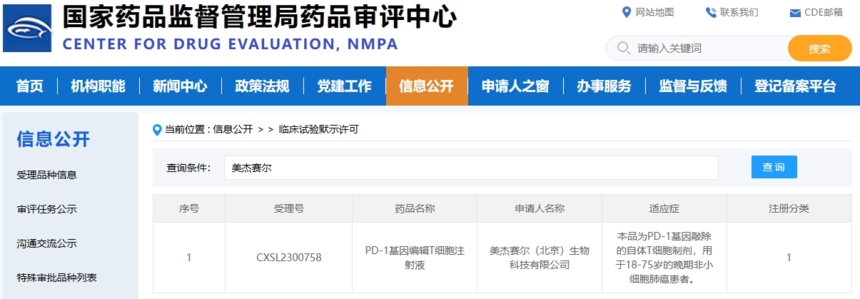
美杰赛尔PD-1基因编辑T细胞注射液获批临床2024年1月24日 医麦客新闻 eMedClub News 据CDE官网显示,美杰赛尔(北京)生物科技有限公司(以下简称“美杰赛尔”)的PD-1基因编辑T细胞注射液临床试验申请(IND)获批,该产品为PD-1基因敲除的自体T细胞制剂,用于18-75岁的晚期非小细胞肺癌患者。 行业顶流新媒体医麦克对美杰赛尔的报导, “中美生物技术竞赛”的评价如今看来倒是一语成谶,虽然美杰赛尔并没有过多进展披露、商业推广,但这种敢为人先的做法在国内企业犹如当年的星星之火,现在已成燎原之势,PD-1基因编辑T细胞注射液的长期迭代工艺开发历程充分体现了公司的发展理念:科学造福人类、匠心铸就品牌。相信在多年的技术积累沉淀下,本次获批将成为美杰赛尔厚积薄发,一鸣惊人的开端。
药物研发历程 “PD-1基因编辑T细胞注射液”此前由成都美杰赛尔生物科技有限公司与四川大学.华西医院联合完成世界首例基因编辑细胞人体临床试验。自然杂志头版头条新闻评述认为“触发了中美生物技术竞赛”;被高盛集团评为“2018年中国生物技术历程里程碑事件”;首个完整IIT I期临床试验成果发表于国际顶级期刊《Nature Medicine》( 2020年4月)。 尽管本品在IIT I期临床试验中已证明基因编辑细胞产品的科学性和安全性,但公司并未急功近利马上启动IND申报,而是潜心工艺迭代优化、精耕细作,形成了更高效、低毒、稳定的编辑和细胞工程化扩增体系。编辑效率由当初一代工艺的20~30%提升到目前的90%以上,而且细胞编辑后的扩增倍数也大幅提高,药学工艺更加稳定可控。该产品的长期迭代工艺开发历程充分体现了公司的发展理念:科学造福人类、匠心铸就品牌。 基因编辑疗法里程碑事件 2023年11月16日,全球首款CRISPR基因编辑干细胞疗法(Exa-cel,CASGEVY™)获英国药品监管机构MHRA有条件批准上市,用于治疗镰状细胞病(SCD)和输血依赖性β-地中海贫血(TDT)。同年12月8日,美国食品药品监督管理局(FDA)宣布批准该产品上市,用于治疗镰状细胞病(SCD)。分析预测价格百万美元以上,这是CRISPR基因编辑细胞疗法里程碑事件。 科技创新性、产业引领性 美杰赛尔是一家以细胞药品、基因编辑、表观遗传等领域技术研究及产品开发为主的高科技企业,公司致力于CRISPR基因编辑创新疗法(具有科技创新性和产业引导性)。基因编辑疗法不仅在单基因遗传病,更在对人类健康危害最大、涉及多种基因复杂机制的实体瘤治疗方面潜力巨大,这也是成都美杰赛尔致力的主要方向之一。本次获批临床默示许可的“PD-1基因编辑T细胞注射液”,是成都美杰赛尔生物科技有限公司研发、生产、并通过其全资子公司美杰赛尔(北京)生物科技有限公司向国家药监局申报的细胞一类新药,也是四川省第一个获批IND的细胞一类新药。随着本次IND临床默示许可,企业加速推动相关产业化进程。 |